Good Tech
La tecnologia può salvarci la vita o attenta ogni giorno alla nostra salute? Probabilmente entrambe le cose, la differenza la fa il nostro modo di viverla. Impariamo a trarne il meglio e a padroneggiarla, scoprendo come evitare che ci si ritorca contro!
Articoli recenti in Good Tech

Aston University: la stimolazione meccanica può prevenire le cadute e rafforzare i muscoli
Seconda una ricerca condotta dalla Aston University, le vibrazioni meccaniche potrebbero influire positivamente sullo sviluppo muscolare, migliorando il controllo dell’equilibrio. Vediamo insieme cosa dice lo studio
di: Letizia Vaccariello
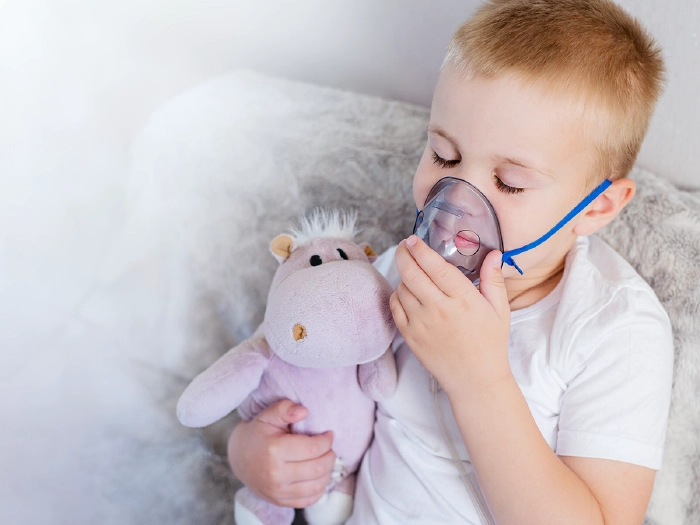
Aerosol contro il raffreddore: quale scegliere?
Calano le temperature e cominciano ad affacciarsi i primi malanni della stagione. Un po’ di tosse, del raffreddore insistente? Ecco spuntare il dispositivo medico presente in tutte le case: l’aerosol. Sei sicuro di averlo sempre utilizzato correttamente?
di: Benedetta Baronti
Come funziona la crema solare? Ecco la guida per proteggere la tua pelle senza rinunciare all’abbronzatura
Se non siete sicuri di quale protezione sia migliore per la vostra pelle, vi spieghiamo come funzionano le creme solari e come leggere consapevolmente le etichette dei flaconi.
di: Diletta Severi